| ANASAYFA |
|
FİRMA PROFİLİ |
|
ÜRÜNLERİMİZ |
|
İNSAN KAYNAKLARI |
|
İRTİBAT |
|
DÖKÜM BİLGİSİ |
|
|
ATOM Atomların varlığı varsayımı gerçekten çok eskilere dayanır."Maddeyi durmadan bölersek, bu işin sonunda nereye varılır?" sorusuna bir cevap getirmek çabasıyla üretilmiş varsayımlardan biridir bu.Yüzyıllar boyunca pek çok düşünür ve bilim adamı tarafından basit, ama olgunlaşmamış kuramlar önerilmiştir.Ama sorun oldukça karmaşıktı, ancak yavaş yavaş ve giderek aydınlanabildi. Kısası, deneyler ve aklı yürütmeyle şu sonuca varıldı:Dünya üzerinde egemen olan koşullar altında cisimlerin büyük çoğunluğu, görece kararlı moleküllerden oluşur;hidrojenden uranyuma, kütleleri 1den 240a kadar değişen yüz kadar farklı atom vardır.En azından iki atomun (benzer veya farklı) aralarında bağ kurabilme yatkınlığı sayesinde birleşmesi, moleküllerin ve kristallerin olağanüstü çeşitliliğini doğurur. Moleküllerin bileşimi ve tepkimelerin incelenmesi, kimyanın konusuna girer.100 kadar farklı atom bile (bunların varlıkları ancak 1900lü yılların sonlarında kabul edilmiştir) göze çok görünmektedir.Atomların, yapı değiştirmesine dayalı olarak ortaya çıkan radyoaktifliğin incelenmesi ve ısıtıldıklarında ışık yayma özelliklerinin ortaya çıkarılması, atomların da en basit ve en temel cisimler olmadığını ortaya koymuştur.Bunların içinde, hepsi birbirinin aynı ve negatif elektrik yükü taşıyan hafif parçacıklar olan elektronlar ile, çok daha ağır ve pozitif yüklü bir çekirdek yer almaktadır.Her çekirdek tipi bir elemente özgüdür ve atom kütlesinin nerdeyse tümünü içerir 1911de Rutherfodun gerçekleştirdiği bir deney, birçok başka fizik deneyine model olmuştur.Bu deney, ağır çekirdeğin atom içinde işgal ettiği hacmin, çekirdeğin elektriksel çekim kuvveti altında sürekli olarak hareket eden hafif elektronların kapladığı hacimden çok daha küçük olduğunu göstermiştir.O zamandan beri atomlar,merkezdeki bir çekirdek çevresinde dolanan elektronlardan oluşan çok küçük Güneş sistemleri olarak kabul edilir olmuştur. Elektronlarla çekirdek arasında sürekli etkiyen bir çekim kuvvetinin mevcudiyetine karşılık, neden elektronların çekirdeğe yapışmadığını açıklamaya yönelik çabalar sonucunda Bohr atomu modeli ortaya çıktı.Bu modelde ve gezegenlerde olduğunun tersine, elektronların ancak bazı özel yörüngeleri işgal edebileceği kabul edilmek zorunda kalındı.Bu durum nedeniyle geliştirilmiş olan kuvantum fiziği, atom ve çekirdek ölçeğindeki olaylarla parçacıklar fiziğinde geçerli olan çok daha küçük ölçeklerdeki olayları tanımlamakta yararlanılan kavramsal çerçeveyi sağlar. En güçlü mikroskopların bile göremeyeceği kadar küçük bir alanda dönüp-duran onlarca elektron, atomun içinde çok karışık bir trafik yaratır. Burada dikkat çeken en önemli nokta, çekirdeği elektrik yükünden oluşan bir zırh gibi kuşatan bu elektronların atomun içinde en ufak bir kazaya yol açmamalarıdır. Üstelik atomun içinde yaşanacak en ufak bir kaza atom için felaket olabilir. Ama böyle bir kaza asla gerçekleşmez; tüm işleyiş mükemmel bir düzen ve kusursuz bir sistem içinde devam eder. Çekirdeğin çevresinde saniyede 1.000 km. gibi akıl almaz bir hızla hiç durmadan dönen elektronlar, birbirleriyle bir kez bile çarpışmazlar.
ÇEKİRDEK: Çok küçük bir hacim içindeki çekirdek, atomun A kütlesinin büyük kısmını oluşturur ve bu çekirdeğin Z elektrik yükü, elektronların sayısı Zyi, yani atomun kimyasal türünü belirler.1920 yılına kadar bilinen yegane parçacıklar, proton ve elektron olduğu için, çekirdeğin A sayıda protondan oluştuğunu, bunlardan bazılarının elektronlar tarafından (çevredeki dış elektronlardan farklı olan elektronlar) nötrleştirildiğini öne sürmek doğaldı, ama bu elektronların çekirdek içinde nasıl saklandıklarını anlamak da hayli zordu.Rutherford nötr parçacıklar (nötronlar) önermişti, bunların kütlesi protonun kütlesine yakın olmalıydı;ancak 1932 yılında Chadwick, nötronu tam anlamıyla kanıtladı:çekirdek içinde elektron yoktu. Çekirdeklerle elektronlar arasında var olan elektriksel kuvvetleri açıklamak için tasarlanan kuvantum elektrodinamiği, bu kuvvetlerin fotonların alışverişiyle, yani sıfır kütleli elektromanyetik dalgalar olan ışık parçacıklarının değişimiyle aktarıldığını ortaya koyuyordu. Bu kuramdan yararlanan ve çekirdeklerin çok küçük boyutlu parçacıklar olmasını hesaba katan Yukava, nükleonlar arasında gerçekleşen haberci bir parçacık, yani mezon alışverişi sonucunda, kısa mesafelerde etkiyen güçlü bir kuvvetin (veya etkileşimin) ortaya çıktığını öne sürdü ve mezonun kütlesini hesapladı.Bugün pion denen bu mezon, 1947 yılında kozmik ışın etkileşimi sırasında tanındı.Bu buluş çekirdeğin "mezon" kuramını doğruluyordu. Ama bu kuram, çekirdeklerin bütün özelliklerinin tanımlanması için yeterli değildi:mesela biçim, kararlılık koşulları, çarpışmalar vb. gibi özellikler.Bütün bu sorular, her zaman çok canlı bir bilim dalı olan çekirdek fiziğinin (nükleer fizik) konusunu oluşturmaktadır. TEMEL PARÇACIKLARElektron:Gerek Daltonun gerekse yunanlıların kuramlarında atom,maddenin en küçük taneciği olarak kabul edilmişti.19.yüzyılın sonlarına doğru atomun kendisinin de daha küçük taneciklerden oluştuğu düşünülmeye başlandı.Atom hakkındaki düşüncelerde meydana gelen bu değişikliğe elektrikle yapılan deneyler neden oldu. 1807-1808 yıllarında ünlü İngiliz kimyacısı Humphry Davy bileşikleri ayrıştırmak için elektrik kullanarak beş element (potasyum,sodyum,kalsiyum,stronsiyum ve baryum) buldu.Bu çalışmalarına dayanarak Davy , bilesiklerde elementlerin elektriksel nitelikli çekim kuvvetleriyle bir arada tutulduklarını önerdi. Vakumdan elektrik akımının geçirildiği deneyler 1859 da Julius Plücker katod ışınlarını bulmasına yol açtı.Katot ışnları elde etmek için havası iyice boşaltılmış bir cam tüpün uçlarına iki elektrod yerleştrilir.Bu elektrodlara yüksek gerilim uygulandığında katot adı verilen negatif elektroddan ışınlar çıkar.Bu ışınlar negatif yüklüdür doğrusal yol izler ve katodun karşısındaki tüp çeperlerinin ışık saçmasına sebep olur. 19.yüzyılın son yıllarında katot ışınları ayrıntılı olarak incelendi.Birçok bilim adamının deneyleri sonucunda katot ışınlarının hızla hareket eden eksi yüklü parçacıklar olduğu ortaya çıktı ve bu parçacıklar daha sonra Stoneyin önerdiği gibi elektron adı verildi. Katottan çıkan elektronlar katot için hangi metal kullanılırsa kullanılsın aynı özelliktedir.Zıt yükler birbirini çektiğinden katot ışınlarını oluşturan elektron hüzmeleri yolları üzerinde üstte ve altta bulunan zıt yüklü iki levha arasından geçerken pozitif yüklüsüne doğru çekilirler.Demek ki bir elektrik alanı içinde katot ışınları normal doğrusal yollarından saparlar.Bu sapmanın açısı : 1. Tanecik yükü ile doğru orantılıdır.Yükü büyük olan tanecik az yük taşıyan tanecikten daha çok sapar. 2. Tanecik kütlesi ile ters orantılıdır.Kütlesi büyük olan tanecik küçük olandan daha az sapar. Bundan dolayı yükün kütleye oranı bir elektrik alanı içinde elektronların doğrusal yoldan ne kadar sapacağını belirler.elektronlar magnetik bir alan içinde de sapma gösterirler.Fakat bu durumda sapma uygulanan magnetik alana dik yöndedir. Katot ışınlarının elektrik ve magnetik alanlar içindeki sapmalarını inceleyen Joseph T. Thomson , 1897de elektron için değerini saptadı bu değer: E/M=-1,7588.10 üzeri sekiz coul /g dır. Coul uluslar arası sistemde elektrik yükü birimidir.Bir kulon bir amperlik akım tarafından iletkenin belirli bir noktasından bir saniyede taşınan yük miktarıdır. Elektron yükünün duyar olarak ölçümü ilk defa Robert A. Milikan tarafından 1909 da yapıldı.Milikanın deneyinde x-ışınları etkisi ile havayı oluşturan moleküllerden elektronlar koparılır.Çok küçük yağ damlacıkları da bu elektronları alıp elektrik yükleri ile yüklenirler.Bu yağ damlacıkları iki yatay levha arasından geçirilirler.Yağ damlacıklarının düşüş hızları ölçülerek kütleleri hesaplanır. Yatay levhalara elektrik akımı uygulandığında negatif yüklü damlacık pozitif yüklü levhaya doğru çekileceğinden damlacığın düşüş hızı değişir.bu koşullar altında düşüş hızı ölçülerek damlacığın yükü hesaplanabilir.Belli bir damlacık bir veya daha çok sayıda elektron alabileceğinden bu yöntemle hesaplanan yükler daima birbirinin aynı değildir.Fakat bu yükler hep belli bir yük değerinin katları olduğundan bu yük değeri bir elektronun yükü kabul edilir. Proton:Nötral bir atom veya molekülden bir veya daha çok elektron koparıldığında geriye kalan tanecik koparılan elektronların tolam eski yüküne eşit miktarda artı yük kazanır.Bir neon atomundan bir elektron koparıldığında geriye kalan tanecik koparılan elektronların toplam eksi yüküne eşit miktarda artı yük kazanır.Bir neon atomundan bir elektron koparıldığında bir Ne(+) iyonu oluşur.Bir elektriksel deşarj tüpünde katot ışınları tüpün içinde bulunan gaz atomlarından ve moleküllerinden elektronların çıkmasına sebep oldukları zaman , bu tür artı yüklü tanecikler oluşur.Bu artı yüklü iyonlar eksi yüklü elektroda doğru hareket ederler.Eğer katot delikli bir levhadan yapılmışsa artı yüklü iyonlar bu deliklerden geçerler.Katot ışınlarının elektronları ise ters yönde hareket ederler. Pozitif ışınlar adı verilen bu artı yüklü iyon demetleri ilk defa 1886 da Eugen Goldstein tarafından bulundu.Pozitif ışınların elektrik ve magnetik alanların etkisinde sapmaları ise 1898 de Wilhelm Wien ve 1906 da J.J. Thomson tarafından incelendi.Artı yüklü iyonlar için e/m değerlerinin saptanmasına , katot ışınlarının incelenmesinde kullanılan yöntemin hemen hemen aynısı kullanıldı.Deşarj tüpünde değişik gazlar kullanıldığı zaman değişik tür artı yüklü iyonlar oluşur. Proton adı verilen bu tanecikler bütün atomların bir bileşenidir.Protonun yüklü elektronun yüküne eşit fakat ters işaretlidir. Bu yüke yük birimi denir.Proton artı bir elektrik yük birimine , elektron ise eksi bir elektrik yük birimine sahiptir.(Protonun kütlesi elektronun kütlesinin 1836 katıdır). Nötron:Atomlar elektrik yükü bakımından nötral olduklarından bir atomun içerdiği proton sayısı elektron sayısına eşit olmalıdır.Atomun toplam kütlesini açıklayabilmek için 1920 de Ernest Rutherford atomda yüksüz bir taneciğin var olduğunu savundu.Bu tanecik yüksüz olduğundan onu incelemek ve tanımlamak zordu.Fakat 1932 de James Chadwick nötronun varlığını kanıtlayan çalışmalarını sonuçlarını yayınladı.Chadwick , nötronların oluştuğu bazı nükleer tepkimelerin verilerinden nötronun kütlesini hesaplayabildi.Bu tepkimelerde kullanılan ve oluşan bütün taneciklerin kütlelerini ve enerjilerini göz önüne alarak Chadwick nötronun kütlesini hesapladı.Bu kütle protonun kütlesinden biraz daha büyüktü. Günümüzde daha birçok atom altı tanecik bulunmuştur.Fakat bu taneciklerin atom yapısı ile olan ilişkisi çok iyi bilinmemektedir.Kimyasal çalışmalar için atomun yapısı elektron , proton ve nötronun varlığına dayanarak yeterince açıklığa kavuşturulmuştur. İZOTOPLARBelli bir elementin bütün elementlerinin atom numarası aynıdır.Fakat bazı elementler kütle numarası bakımından farklılık gösteren çeşitli tipte atomlardan oluşmuştur.Aynı atom numarasına fakat farklı kütle numarasına fakat farklı kütle numarasına sahip atomlara izotop atomlar adı verilir. Görüldüğü gibi izotoplar çekirdeklerindeki nötron sayısı bakımından farklıdırlar;bu da doğal olarak atom kütlelerinin farklı olduğu anlamına gelir.Bir atomun kimyasal özellikleri ilke olarak atom numarası ile belirtilen proton ve elektron sayısına bağlıdır.Bundan dolayı bir elementin izotopları birbiri ile hemen hemen aynı olan kimyasal özelliklere sahiptir.Bazı elementler doğada tek bir izotop halinde bulunurlar.Fakat çoğu elementlerin birden çok izotopu vardır.Örnek olarak kalayın 10 doğal izotopu vardır. Kütle spektrometresi bir elementte kaç izotop bulunduğunu , her izotopun tam olarak kütlesini ve bağıl miktarını saptamak için kullanılır.Buharlaştırılmış madde , elektronlarla bombardıman edilerek artı yüklü iyonlar oluşturulur.Bu iyonlar eksi yüklü bir levhaya doğru çekilerek bu levha üzerinde bulunan dar bir aralıktan hızla geçirilirler. İyot demeti bundan sonra magnetik bir alan içinden geçirilir.yüklü tanecikler magnetik bir alan içinde dairesel bir yörünge izlerler.Taneciğin yükü arttıkça doğrusal yörüngesinden sapma da artar.Bu nedenle , magnetik bir alanda artı yüklü bir iyonun izlediği dairesel yörüngenin yarıçapı o iyonun e/m değerine bağlıdır. Değişik e/m değerine sahip iyonların bu son aralıktan geçmesi ise magnetik alan şiddeti veya iyonları hızlandırmak için kullanılan voltaj ayarlanarak sağlanır.Böylece aygıttaki farklı iyon türlerinden her biri bu aralıktan ayrı ayrı geçirilirler.Detektör her farklı iyon demetinin şiddetini ölçer ; bu iyon şiddeti örnekte bulunan izotopların bağıl miktarına bağlıdır. BAZI ATOM PARÇACIKLARI: Banyonlar:Üç kuvarktan oluşan kadronlar. Bozonlar:Temel fiziksel kuvvetleri taşıyan parçacıklar. Elektronlar:En hafif leptonlar.Elektrik yükleri 1dir.Elektriksel ve kimyasal tepkimelerde önemli roller üstlenirler. Fermiyonlar:Spin değeri 1/2, 2/3 gibi buçuklu olan tüm parçacıklar.Peptonlar ve banyonlar birer fermiyondur. Fotonlar:Elektromagnetik kuvveti taşıyan bononlar.Işığı oluşturan parçacıklar fotonlardır. Glüonlar:Kuvarklar arasındaki kuvvetli etkileşimi taşıyan bozonlar. Gravitonlar:Kütle çekimi kuvvetini taşıdığı varsayılan bononlar.Gravitonlar gerçekte henüz gözlemlenememiştir. Hadronlar:Kuvarklardan oluşan tüm parçacıklar. Kuvarklar:Nötronları ve protonları oluşturan parçacıklar.Kuvarsların koku alarak adlandırılan altı türü vardır:Yukarı,aşağı,büyülü,acayip,üst ve alt. Leptonlar:Çekirdeğin dışında yer alan parçacıklar.Altı tür lepton vardır:Elektron,mü on,tau ve bunların nötrinoları. Mezonlar:Bir kuvark ile bunun karşıt kuvarkından oluşan hadronlar. Müonlar:Elektrondan biraz daha ağır leptonlar.Evrenin oluşumunun ilk anlarında var olan bu parçacıklar bugün ancak parçacık hızlandırıcılarında üretilmekte ve ender olarak kozmik ışınlarda bulunmaktadır. Nötrinolar:Elektrik yükü ve gözlemlenebilir bir kütlesi olmayan parçacıklar. Nötronlar:Protonlarla birlikte atom çekirdeğini oluşturan yüksüz temel parçacıklardır. Protonlar:Nötronlarla birlikte atom çekirdeğini oluşturan artı yüklü temel parçacıklar. Taular:En ağır leptonlar.Evrenin oluşumunun ilk anlarında var olan bu parçacıklar bugün ancak parçacık hızlandırıcılarında üretilmekte ve ender olarak kozmik ışınlarda bulunmaktadır. Taşıyıcı mezonlar:(W ,W ve Z bozonları olarak da adlandırılır).Bazı radyoaktif bozunum türlerine neden olan zayıf etkileşimleri taşıyan bozonlar. KUVARKLAR,LEPTONLAR,BOZONLAR 1960larda sürdürülen yoğun araştırmalar sonucunda bu temel parçacıkların, kuvark denen daha da temel birimlerden oluştuğu anlaşıldı.1980lerin ortalarında da maddenin temel bileşenlerinin, atom çekirdeğini bir arada tutan kuvvetli etkileşimden etkilenen kuvarklar ile kuvvetli etkileşime girmeyen leptonlar olduğu sonucuna ulaşıldı.Kuvarklar kesirli elektrik yüküne sahip, spin değerleri ½ olan kütleli parçacıklardır (Spin ya da fırıl, bilinen parçacıklarda var olan açısal momentumdur).Kuvarklar her zaman bir arada bulunur. Birbirlerinden "koku" denen fiziksel bir özellikle ayrılan altı tip kuvark, yani altı ayrı kuvark kokusu vardır.Bu kokular yukarı,aşağı,üst,alt,acayip ve büyülüdür (İngilizce adları up,down,top,bottom,strange ve charmed).Olağan maddedeki protonlarda ve nötronlarda bunlardan yalnızca ikisine, yukarı ve aşağı kuvarklara rastlanır.Öbür dördü (üst,alt,acayip ve büyülü kuvarklar) saniyenin kesri kadar bir sürede kendiliğinden bozunan kararsız parçacıklarda bulunur.Yukarı,büyülü ve üst kuvarkların elektrik yükü 2/3;aşağı,acayip ve alt kuvarkların elektrik yükü ise 1/3tür.Kuvarklardan oluşan tüm parçacıklara hadron denir.Uç kuvarktan oluşan protonlar, nötronlar ve öbür hadronlar baryon olarak adlandırılır.Tek bir kuvark ile bunu karşıt kuvarkından oluşan hadronlara ise mezon denir.Spin değeri buçuklu olan (1/2, 2/3, vb.) tüm parçacıklar fermiyon adıyla anılır.Leptonlar ve baryonlar bu gruba girer. Leptonlar her zaman çekirdeğin dışında bulunur, çünkü kuvarkların tersine, çekirdeği bir arada tutan kuvvetli etkileşimden etkilenmezler.Altı tip lepton vardır ve bunlar her zaman bir arada bulunur.Leptonların elektrik yükü 1, spin değerleri ise 44 ½dir.Elektronlar ile müonlar (mü parçacıkları) ve tabu parçacıkları bu kategoriye girer.Her lepton, elektrik yükü ve görünür bir kütlesi olmayan bir nötrinoyla ilişkilidir.Leptonlar yalnızca elektromagnetik kuvvetten, zayıf çekirdek kuvvetinden ve kütle çekimi kuvvetinden etkilenirler.(Zayıf çekirdek kuvveti, çekirdeğin kendiliğinden parçacıklar saldığı çekirdek bölünmesi sırasında etkir).
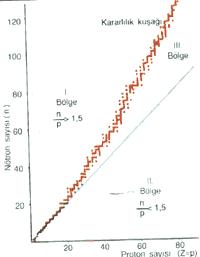
Kuvarklar ve leptonlar maddenin temel parçacıklarıdır, ama bozon olarak adlandırılan bir başka parçacıklar kümesi daha vardır.Görelilik ve kuvantum kuramlarına göre tüm kuvvetler parçacıklar arasındaki etkileşimin bir sonucudur ve kuvarklar ya da leptonlar arasındaki tüm etkileşimler bozonlar tarafından taşınır.En tanınmış bozon, elektromagnetik kuvveti ileten fotondur.Kuvarkları birleştirerek proton ve öbür hadron türlerinin oluşmasını sağlayan kuvvetli etkileşim, glüon olarak adlandırılan sekiz bozonluk bir küme tarafından taşınır.Işınımın (radyoaktifliğin) oluşmasını sağlayan ve Güneşin enerji üretebilmesi için gerekli olan zayıf kuvvet ise, taşıyıcı mezon ya da vektör mezonu denen üç bozon tarafından iletilir.Bunlara bazen W ,W ve Z bozonları da denir.Foton ve glüon kütlesiz, taşıyıcı mezonlar ise oldukça ağırdır.1983te İşviçrenin Cenevre kentinde Avrupa Nükleer Araştırma Örgütü laboratuarında W ve Z parçacıkları için öngörülen biçimde oluşan ve bozunan parçacıklar saptanmıştır. Tablo:Bunlar maddeyi oluşturan temel parçacıklardır.Parçacıkların bazı fiziksel özelliklerini belirten renk ve koku tanımlarının parçacık fiziğinde günlük yaşamdakinden farklı teknik anlamları vardır.Parçacıkların kütleleri birbirinden oldukça farklıdır ve kolaylık sağlaması bakımından 1 birim olarak alınan protonun kütlesine göre verilmiştir.Elektrik yükü de protonunkine göre belirlenmiştir.(ν ve t parçacıklarının henüz doğrudan gözlemlenememiştir, ama varlıklarına ilişkin güçlü belirtiler bulunmaktadır.)Her parçacığın, elektrik yükü, rengi ve kokusu ters işaretli olan bir karşıt parçacığı vardır;karşıt parçacıklar ayrıca listeye alınmamıştır. KARŞIT PARÇACIKLARKuvantum kuramının geliştirilmesinden kısa bir süre sonra, 1930ların başlarında kuramsal fizikçi P.A.M Dirac karşıt parçacıkların olduğunu öne sürdü.Her temel parçacık için kütlesi aynı, ama elektrik yükü (ve herhangi bir başka yükü) ters işaretli olan bir başka parçacığın bulunması gerekiyordu.Bugün bu varsayım kanıtlanarak doğrulanmıştır.Örneğin, elektronun karşıt parçacığı pozitron, protonunki karşı proton (ya da antiproton) ve kuvarkınki karşıt kuvarktır (ya da antikuvark). ATOM PARÇACIKLARININ ÖZELLİKLERİ Her atom parçacığının bazı ayırt edici özelliği vardır.Bu özelliklerin başlıcaları kütle, elektrik yükü, bakışım, renk ve kokudur. KÜTLE VE ELEKTRİK YÜKÜ Her temel parçacığın bir özgül kütlesi vardır.Parçacıkların kütleleri birbirinden çok farklı olabilmekte, ana bunun nedeni henüz bilinmemektedir.Parçacıkların bilinen bir başka özelliği de elektrik yükleridir.Bozonlar ile leptonların elektrik yükü elektronunkiyle aynı (-1) olabileceği gibi, bozonlarınki bunun tam ters işaretlisi de (+1) olabilir.Nötron ya da nötrino gibi yüksüz (nötr) bozonlar ve leptonlar da vardır.Kuvarkların elektrik yükü ise -2/3tür. BAKIŞIM Herhangi bir madde üzerinde yapılabilen ve maddede değişikliğe yol açmayan bir işlem varsa, o maddenin bakışımlı olduğu söylenir.Örneğim bir dairenin, merkezinden geçen ve ona dik olarak geçen çizginin çevresinde döndürülmüş olup olmadığı belirlenemez.Benzer biçimde, bir eşkenar üçgen merkezinden dik olarak çıkan bir çizginin .evresinde 120 derece döndürülürse üçgenin görünümünde herhangi bir değişiklik olmaz.Matematikçiler, çeşitli sistemlere uygulandığında bunlarda herhangi bir değişikliğe yol açmayan işlemleri genelleştirmiş ve sınıflandırmışlardır;buna gruplar kuramı denir.Eğer bazı maddeler üzerinde, bu maddelerde ve aralarındaki ilişkilerde bir değişikliğe neden olmadan uygulanabilecek bir işlemler kümesi varsa, bu kümeye bakışım grubu denir.Bu maddelerin bakışım işlemleri altında birbirlerine dönüştükleri söylenir.Bakışım gruplarının çeşitli adları vardır;doğadaki kuvvetlerin ve parçacıkların nasıl düzenlenmiş olduklarının açıklanması bakımından özel önem taşıyan bazı özel bakışım grupları SU(N) grupları olarak adlandırılır.Buradaki N, bakışım işlemlerinin uygulanabileceği temel madde sayısını gösterir. Fizikçiler parçacıkları ve bunların arasındaki etkileşimleri belirleyen yasaların belirli işlem kümeleri altında değişmediğini saptamışlardır.Özellikle 2. Dünya Savaşından sonra keşfedilen parçacıkların, SU(3) bakışım grubu işlemleri altında birbirine dönüşen kümeler oluşturduğu ortaya çıkmıştır.Ama, gözlemlenen parçacık kümeleri, olanaklı en basit maddeler kümesi değildir..Gözlemlenen parçacıklar değişik bir biçimde üçgene benzerler ve 120derecelik döndürmeler yapıldıkça doğa yasaları değişmemiş, böylece birçok parçacık kümesi çok basit şekilde gözlemlenebilmiştir. 1964te Murray Gell-Mann ve George Zweig, birbirlerinden bağımsız olarak, proton,nötron ve keşfedilmiş birçok parçacığı da içermek üzere tüm hadronların bir başka madde düzeyinden oluştuğunu ileri sürdüler;bu madde Gell-Mannın önerisi uyarınca kuvark olarak adlandırıldı.Kuvarklar ayrıca, "koku" denen fiziksel özelliklerine göre u,d ve s kuvarkları olarak ayrıldı.(Kuvark sözcüğü James Joyceun Finnegans Wake adlı romanında geçen bir cümleden alınmıştı.) Daha sonraki fizikçilerin de çalışmalarında benzer sonuçlara varması Gell-Mann ve Zweigın görüşünün doğrulanmasına ve kuvarkların kuvvetli etkileşime giren temel parçacıklar olarak kabul edilmesine yol açtı.Örneğin 1960ların sonlarında ABDnin California eyaletindeki Stanford Doğrusal Hızlandırıcı Merkezinde gerçekleştirilen bir deney sonucunda protonların ve nötronların kuvarklardan oluştuğu kanısı kesinleşti.Bu deneyde araştırmacılar Ernest Rutherfodun atom çekirdeğini keşfetmesini sağlayan tekniğin bir benzerini uyguladılar.Bir kez protonlara çok yüksek enerjili elektronlar çarptırıldı ve şaşılacak kadar çok sayıda elektronun doğrudan protonların arasından geçmek yerine, büyük açılarla geri yansıdığı görüldü.Dikkatle sürdürülen incelemelerin ardından da protonların temelde üç noktamsı parçacıktan, yani kuvarklardan oluştuğunun kabul edilmesi gerektiği sonucuna varıldı.(Bu deney sırasında ayrıca, kuvarkları birleştirerek protonun oluşmasını sağlayan ve glüon denen parçacıkların varlığına ilişkin kanıtlar da elde edildi.) Bilim adamlarının maddenin kuvarklardan oluştuğuna inanmalarını sağlayan başka nedenler de vardır.Bunlardan biri, kuvarkların proton,nötron ve öbür hadron türlerini oluştururken ancak belirli sayısal birleşimlerde bir araya geldiklerinin anlaşılmış olmasıdır.Protonlar ve nötronlar üç kuvarktan, mezonlar ise tıpkı pionlar gibi kuvark-karşıt kuvark çiftlerinden oluşur.kuramın geçerli olabilmesi için ancak belirli hadron biçimlerinin bulunması, bazılarının ise bulunmaması gerekir ve her iki koşul da sağlanmıştır.Bir başka neden de kuvarkların hem kuvvetli, hem de zayıf etkileşimlere nasıl girdiğini tanımlayan kuramların pek çok önemli deneyi doyurucu biçimde açıklayabilmesidir Geçmişte maddenin yapısı araştırılırken ulaşılan her aşamada, keşfedilen yeni parçacığın da bir iç yapısı olduğunu düşündüren ipuçları elde ediliyordu.Örneğin, proton keşfedildiğinde bu parçacığın magnetik alanlarla noktamsı bir parçacıktan beklenen biçimde etkileşime girmediği görülmüş ve üzerine çarptırılan elektronları saçılıma uğratınca da bir iç yapısı olduğu anlaşılmıştı.Oysa çok yakınlarına kadar ulaşılıp imcelenmelerine karşın kuvarkların ve leptonların bir içi yapısı olduğunu gösteren herhangi bir belirtiye rastlanmamıştır. Kuvarkların bu bakımdan çok önemli olabilecek bir başka özelliği daha vardır.Çok çeşitli şekillerde gözlemlenebilmelerine karşın, bu parçacıkların yalın halde ayrılıp elde edilemeyeceğine inanılmaktadır.Bilindiği kadarıyla bu parçacıkları bir arada tutan kuvvet, aralarındaki uzaklık artsa bile sabit kalır ve bu yüzden bir çift kuvarkı birbirinden ayırmak için gittikçe daha fazla enerjiye gereksinim duyulur.Ama sisteme yüklenen enerji belirli bir düzeye ulaştığında bu kez sistem bir kuvark-karşıt kuvark çifti oluşturur.Bu durumda da sistemden ancak qqq ya da qq birleşimleri çıkar;bu birleşimler ise normal hadronlardan başka bir şey değildir.Kuvarkların ayrılamayacağı ve yalnızca hadronları oluşturan birleşimlerinin görülebileceği tezine sınırlanma denir.Maddenin bölünebilirliğine ilişkin tarihsel problemin yeni çözümü belki de bu sınırlanma ilkesidir.Gelecekte yapılacak deneyler maddenin daha ileri düzeylerinin olup olmadığını ortaya çıkaracaktır, ama bilim tarihte ilk kez maddenin en temel ve parçalanamaz bileşenlerine ulaşmış gibi görünüyor. KİLOMETRE TAŞLARI 1896-Radyoaktiflik bulundu. 1898-Polonyum,sonra radyum (P. VE M. Curie), alfa ve beta ışınları (Ernest Rutherford) bulundu. 1900-Elektromanyetik yapıda olan Gamma ışınları bulundu(P.Villa-RD). 1911-İzotop kavramı ortaya çıktı (Aynı fiziksel ve kimyasal özelliklere sahip ama atom kütleleri farklı elementler). 1932-Nötron keşfedildi (J. Chadwick). 1932-W. Pauli ve E. Fermi beta radyoaktifliğinin yanısıra nötrino denen çok girişken yüksüz bir parçacığın da yayımlandığını da kanıtladı. 1934-J.F. VE I. Joliot-Curie yapay radyoaktifliği ve β+radyoaktifliğini buldu. 1935-Nükleer kuvvetin Mezon kuramı (Yukava). 1938-Nükleer parçalanma (Fisyon) bulundu. 1970- Ağır iyon hızlandırıcıları, çekirdeklerin kararlılık koşullarını- araştırmaya imkan verildi. Radyoaktiflik:Kendiliğinden ışıma yapabilen maddeler radyoaktif maddelerdir .Radyoaktiflik çekirdek yapısıyla ilişkilidir. Radyoaktif bir atom hangi bileşiğin yapısına girerse, o bileşiği radyoaktif yapar. Radyoaktif maddeler kuvvetli birer enerji kaynağıdır . Radyoaktif elementler bu enerjiyi kendiliklerinden yayınlarlar ve bu olayı hiçbir şekilde durdurmak mümkün değildir. Atomun çekirdeğinde bulunan temel tanecikler proton ve nötron olup bunlara nükleon adı verilir. Radyoaktiflik özelliği ; elementlerin katı, sıvı gaz ya da bileşik halinde olması etkilemez. Atomun kütlesi, çekirdekteki proton ve nötronların kütleleri toplamına eşit olması gerekirken daha küçüktür, bu aradaki kütle farkı ; E=m . c2 şeklinde enerjiye dönüşür. Bu enerjiye bağlanma enerjisi denir. Bir atomda nükleon başına düşen bağlanma enerjisi ne kadar büyükse, atom o kadar kararlı yapıda olur. Bu enerji çekirdekteki nükleonları bir arada tutan enerjidir. Atom çekirdeğinde kararlılık ya da kararsızlık, proton-nötron sayıları arasındaki ilişki şöyle genellenebilir: 1- Atom numarası 1-20 arasındaki atomların çekirdeklerinde proton sayısı = nötron sayısıdır. 2- Atom numarası 20-83 arasındaki çekirdeklerde nötron sayısı proton sayısından fazladır. 3- Atom numarası 83 ten büyük olan elementlerin çekirdekleri kararsız olup radyoaktiftir. 4- Atom numarası ve nötron sayısı çift olan atomların, atom numarası ve nötron sayısı tek olan atomlara göre, daha çok sayıda kararlı izotopu vardır. 5- En kararlı çekirdekler, hem nötron hem de proton sayıları çift olanlardır. 0-8-20-28-50-82 proton veya nötron sayısına sahip çekirdekler özellikle kararlıdır. Bu sayılara sihirli sayılar denir. Radyoaktif Bozunmalar:Atoma dıştan herhangi bir etki olmadan, kendiliğinden bozunarak daha küçük parçalara ayrılması ve bu ayrılma sırasında ışıma yapmasına radyoaktiflik, bu tür ışıma yapan elementlere de radyoaktif atom denir. Radyoaktif lik, Şubat 1896da Henri Becquerel (Henri Bekerel) tarafından, potasyum uranil sülfatın yaydığı ışınların bazı maddelerden geçip fotoğraf plağını karartmasıyla keşfedildi. Radyoaktif elementlerin bileşiklerinde de radyoaktif özelliği aynen görülür. Bu yüzden radyoaktif kimyasal veya fiziksel etkilere ve değişmelere bağlı bir özellik değildir. Sadece çekirdek yapısına bağlı ve çekirdekte olan bir değişmedir. Radyoaktif elementler, radyoaktif ışımalar ile kendiliğinden başka kararlı elementlere dönüşür. Atom çekirdeklerinin kararlığı nötron ve proton sayısıyla ilgilidir. Doğada bulunan atomların nötron sayıları, proton sayılarına göre grafiğe geçirildiğinde aşağıdaki grafik elde edilir. Grafik kararlılık kuşağının dışındaki çekirdekler kararsızdır. Bu elementler radyoaktiftir. Genel olarak n/p < 1,5 olan çekirdekler kararlı ya da az kararlı , n/p > 1,5 olan çekirdekler kararsızdır.Kararsız çekirdek yapısına sahip olan elementler, kararlı bir çekirdek yapısına ulaşmak için alfa, beta, pozitron bozunması ve elektron yakalaması şeklinde bozunmaya uğrayarak ışıma yapar. Bu elementlere ışıma yapan anlamında radyoaktif element denir. Atom çekirdeklerinde nükleon (temel tanecik) başına düşen bağlanma enerjisi o çekirdeğin kararlılığının ölçüsüdür. Atom çekirdeklerinde tanecik sayısı arttıkça bağlanma enerjisi azalır. Çekirdek kararsızlığı arttıkça radyoaktif olma özelliği artar.
Atomlardaki çekirdek olayları kimyasal olaylardan farklıdır. Radyoaktivite ve çekirdek olayları ile ilgili aşağıdaki sonuçlar çıkarılabilir: - Radyoaktiflik, dış etkenlere bağlı değildir. Bir atomun radyoaktifliği sıcaklık, basınç, çözünme, kimyasal tepkimeye girme gibi olaylarla değişmez. - Bir atom radyoaktif ise, o atomun oluşturduğu bileşikler de radyoaktiftir. Kimyasal olaylar radyoaktifliği değiştirmez. - Radyoaktif olaylarda açığa çıkan ya da gereken enerji kimyasal olaylara göre çok fazladır. - Radyoaktif atomlar kararlı çekirdeğe dönüşebilmek için çeşitli ışımalar (Radyoaktif bozunma) yaparlar. Bozunma Çeşitleri :1- Alfa BozunmasıAtom numarası 83ten büyük olan elementler, kararlı bir çekirdek yapısına ulaşmak üzere, atom ve kütle numaralarını azaltarak n/p oranını bire yaklaştırmak isterler. Bunun için alfa bozunmasına uğrayarak He çekirdeğinden ibaret alfa tanecikleri yayınlamaları gerekir. Bu olaya alfa bozunması denir. Kısaca, atomun yapısından bazı parçaların atılmasıdır. Bir alfa ışıması yapan elementin atom numarası 2 , kütle numarası 4 azalır. Alfa ışınlarının özelikleri:1- Fotoğraf filmlerine etki ederler. 2- + yüklü oldukları için elektrik ve manyetik alanda kutupa doğru saparlar. 3- Karşılaştıkları moleküllerden elektron kopararak, iyonlaşmaya neden olurlar. 4- Giricilikleri çok azdır. 2- Beta Bozunması :Beta bozunması n/p oranı kararlılık kuşağından daha büyük izotopların uğradığı bozunmadır. Bu tür atomlar kararlı yapıya ulaşmak için nötron sayılarını azaltmak isterler. Beta bozunmasına uğrayan bir elementin çekirdeğindeki bir tane nötron, bir proton ve bir elektrona dönüşür. Beta bozunmasına uğrayan atomun atom numarası 1 artarken, kütle numarası değişmez ve uğradığı atomun izobarı oluşur. Beta Işınlarının Özellikleri :1- İyonlaştırma özellikleri azdır. 2- Işık hızına yakın bir hızla hareket ederler. 3- Alfa ışınlarından daha çok, gama ışınlarından daha az giricidirler. 4- Fotoğraf filmine etki ederler. 5- Elektrik ev manyetik alanda negatif yüklü oldukları için pozitif kutupa doğru saparlar. Sapmaları alfa ışınlarından daha fazladır. Çünkü bunların kütleleri daha küçüktür. 3- Gama Işıması:Hiçbir zaman tek başına meydana gelmez. Mutlaka bir bozunmadan sonra meydana gelen ışımadır. Bazı atomlar bozunmalar sırasında enerjisini dışarıya veremez, yüksek enerjili durumda kalırlar. Enerjiden kurtulmak için gama ışıması yapıp kararlı duruma geçer. Gama ışıması sırasında atomun atom ve kütle numarasında bir değişiklik olmaz, yeni bir atom meydana gelmez. Gama Işınlarının Özellikleri :1- Alfa ve beta ışınlarından daha fazla giricidir. 2- Yüksüz oldukları için elektrik ve manyetik alanda sapmaya uğramazlar. 3- Kütlesizdirler, fotoğraf filmine etki ederler. 4- Pozitron Işıması :Nötron sayısı proton sayısından az olan radyoaktif atomlar, proton sayılarını azaltmak için çekirdeklerindeki bir protonu nötrona çevirirler. Proton nötron + pozitron Pozitron ışıması yapan bir atomun kütle numarası değişmez, atom numarası 1 azalır. Pozitron taneciği, beta taneciğinin yük bakımından tersidir. 5- Nötron Fırlatılması :Kararsız bir çekirdekten dışarı nötron atılması ile gerçekleşir. Nötron fırlatan bir atomun kütle numarası 1 azalır. Atom numarası değişmez. Atom kendi izotopuna dönüşür. Çok hızlı gerçekleşir, izlenmesi zor bir olaydır. Yapay çekirdek tepkimelerinde gerçekleşir. 6- Elektron Yakalaması :Protonu nötronundan çok olan kararsız çekirdekler [ n/p < 1] çekirdeğe en yakın olan 1s orbitalinden 1 elektron yakalayarak protonu nötrona çevirirler. Pozitron yayınlama ile aynı sonucu verir. 1s orbitalinde boşalan elektronun yerini, yüksek enerjili orbitallerdeki elektronlar birer düşerek X ışınları oluşturarak doldururlar. Atom numarası 1 azalırken, kütle numarası değişmez. Bu olayda elementin izobarı oluşur. Fajans Kanunu :Alfa bozunmasına uğrayan bir element, bozunma sırasında oluşan yeni elemente göre 2 grup önde (sağ) yer alır. Yine beta bozunmasına uğrayan bir element oluşan yeni elemente göre periyodik tabloda 1 grup geride yer alır. Buna fajans kanunu adı verilir. Doğal Radyoaktiflik :Kararlı hale gelmek için atomların kendiliğinden ışıma yapmasına doğal radyoaktif element denir. Atom numarası 83-92 arasındaki elementler doğal radyoaktif elementlerdir. Bunun yanında atom numarası 83den küçük olup doğal radyoaktiflik gösteren elementler de vardır. (K, C, Rb) Bir radyoaktiflik izotop bozunma sonucu başka bir radyoaktif izotopa dönüşür. Bu da bir başkasına dönüşür. Bu işlem kararlı bir çekirdek oluncaya kadar devam eder, böylece radyoaktif bozunma serileri ortaya çıkar. Bu seriler Uranyum(U), Toryum( Th ), Aktinyum( Ac) serisi olmak üzere üç türlüdür. Yapay Radyoaktiflik :Kararlı ya da kararsız elementlerin alfa, nötron, proton gibi tanecikler ile bombardımanında oluşan yeni elementler de radyoaktiftir. Bombardıman yolu ile elde edilen radyoaktif elementlerin bu özelliğine yapay radyoaktiflik denir. 1934 yılında Madam Curienin kızı I.Curie ve damadı F. Joliotun çalışmaları ile hızlanan yapay radyoaktiflik yolu ile birçok yeni element bulunurken teknoloji ve tıbbın gereksinimi olan radyoaktif atomlar yapılmaya başlanmıştır. 400den fazla radyoaktif izotop yapay olarak elde edilmiştir. NÜKLEER ÇEKİRDEK TEPKİMELERİ VE ATOM ENERJİSİ Bağlanma enerjisi grafiği incelendiğinde nükleon(tanecik) başına düşen bağlanma enerjisinin en çok Fe elementlerinde olduğu görülür. Kütle numarası küçük olan atomların kaynaşarak(Füzyon) daha büyük kütle numarasındaki atomlara dönüşmesinde ya da kütle numarası 56dan büyük olan atomların parçalanarak (Fisyon) küçük atomlara dönüşmesinde açığa çok yüksek enerji çıkar. Bu enerjiye Nükleer enerji veya ATOM ENERJİSİ denir. 1. FİSYON (Bölünme) TEPKİMELERİ :Kütle numarası büyük olan atomların hızlandırılmış küçük tanecikler (nötron) ile bombardımanı sonucu daha küçük atomlara bölünmesi tepkimeleridir. Atom bombası bu esasa göre yapılmıştır. 2. FÜZYON (Kaynaşma) TEPKİMELERİ : Kütle numarası küçük olan atomların hızlı tanecikler ile bombardımanı sonucu daha büyük çekirdeklerin oluşmasıdır. Açığa çıkan enerji Fisyon enerjisinden daha büyüktür. Hidrojen bombası bu esasa göre yapılır. RADYOAKTİF BOZUNMA HIZI,YARILANMA SÜRESİRadyoaktif bir elementin herhangi bir anda mevcut olan miktarının yarısının bozunması için geçen süreye yarılanma süresi denir. Yarılanma süresi dış etkenlere bağlı değildir. Bozulan çekirdeğin yapısına bağlıdır. - Bir elementin izotoplarının yarılanma süreleri farklıdır. Radyoaktif maddelerin bozunma hızı çekirdeğin kararsızlığına bağlıdır. Birim zamanda bozunma hızı çok olan çekirdekler kararsızdır. - Radyoaktif bozunma hızı, maddelerdeki radyoaktif atomların sayısı ile doğru orantılıdır. - Bir izotopun saniyede parçalanma sayısı onun radyoaktiflik şiddetini verir. 1gram radyumun saniyede yaydığı parçacık sayısı radyoaktiflik şiddet birimi olarak kabul edilmiştir. Radyoaktiflik şiddet birimi 1 Küri (Curie) ; saniyede 3,7.10 (37 milyar) bozunmadır. (1 Ci ) olarak tanımlanır. (1/Ci )ye Becquerel radyoaktiflik şiddet birimi denir. Yarılanma süresi radyoaktif maddenin miktarına bağlı değildir. Madde miktarı arttıkça ışıma miktarı artar, yarılanma süresi (yarı ömür) değişmez.Yarılanma süresi radyoaktif maddeler için ayırt edici özelliktir. Yarılanma ile maddenin kütlesi tükenmez Radyoaktif maddelerin yarılanma süreleri ile ilgili hesaplamalar için maddenin basınç kütlesi, yarı ömrü, geçen süre, kalan madde miktarı gibi niceliklerin bilinmesi gerekir.
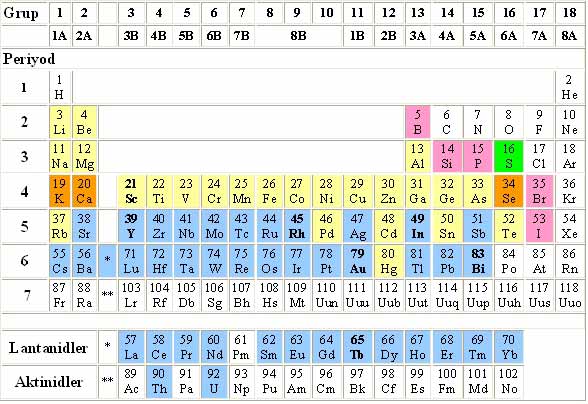
Doğada bulunan bazı elementlerin proton ve nötron sayıları yukarıdaki tabloda verilmiştir. PERİYODİK CETVELBir çok elementi ayrı ayrı incelemek zor bir iştir. Elementlerin incelenmelerini kolaylaştırmak ve özelliklerini daha kolay hatırlayabilmek amacıyla, elementleri bir sınıflamaya tabi tutmayı çok eskiden beri kimyacılar düşünmüşlerdir. Hatta bu sınıflandırmada elementlerin özellikleri, belirli bir düzen içinde değişirse, kimyacıların işi epeyce kolaylaşmış olacaktı. Geçen yüzyılın ortalarında, şimdi bilinen elementlerin yarısından biraz fazlası biliniyordu. Bilinen elementleri, özelliklerine göre bir sınıflandırma yapmak için, o zamanda kimyacılar, değişik fikirler ileri sürmüşlerdir. On dokuzuncu yüzyılın başında, Daltonun ileri sürdüğü atom teorisi ve onu hemen takip eden Avogadro hipotezi, modern kimya alanını açmış; Berzeliusun (Berzelyus) atom kütlelerini tayini ile, atom kütleleri ile elementlerin özelliklerini karşılaştırma imkanı ortaya çıkmıştır. Elementlerin atom kütleleri ile özellikleri arasındaki ilişkiyi ilk sezen Alman kimyacı J.W.Döbereiner (Döbrayner) olmuştur. Döbereiner, 1828 yılında, bazı elementlerin kimyasal özellikleri arasında (CL,BR,I)-(Ca,Bo,Sr)-(S,Se,Te gibi) yakın benzerlikler bulunduğunu görmüş ve bu elementleri triyotlar (üçlüler) olarak gruplandırmıştır. Bu görüş, zamanın kimyacılarını, bütün elementleri içine alan, tam bir sıralama sisteminin var olabileceği düşüncesine götürmüştür. İngiliz kimyacı J.A.R. Newlands (Nivlands) 1864de, o zaman bilinen elementleri atom kütlelerine göre artan bir şekilde sıralamakla, her 7 elementten sonra gelen 8. elementin özelliğinin, bu 8 elementin başlangıç elementinin özelliğine benzediğini görmüştür. Bu şekilde, bir elementten 7 sonra gelen elementin yani 8. elementin aynı özelliğe sahip olmasını müzikteki 8 notaya verilen isme benzeterek, oktav diye adlandırmıştır. Fakat Newlands bu görüşünde pek ileri gidememiş ve kalsiyumdan sonra gelen elementlerin bağlantısını anlayamamıştır. Bugünkü anlama yakın periyodik sistem, 1869 yılında Rus kimyacısı Dimitri Mendeleev (Dimitri Mendelyev) tarafından yapılmıştır. 1870 yılında Alman bilgini Lother Meyer (Lotar Meyır)de Mendeleevden habersiz olarak, bir periyodik cetvel yapmıştır. Bu iki cetvel hemen hemen birbirinin aynıdır. Meyer; elementleri, cetvelinde fiziksel özelliklerine (atom hacimlerine) göre sıralamış, Mendeleev ise, elementlerin elementleri fiziksel özelliklerini ele alacak yerde, değerliliklerini, yani kimyasal özelliklerini dikkate almıştır. Mendeleev, o zaman bilinen ve atom kütlelerini bulunmuş elementleri, atom kütlelerinin artısına göre sıralamakta, elementlerin değerliliklerinin ve öteki özelliklerinin, gitgide değişirken, belirli sayıda elementten sonra tek-rarladığına, yani bu özelliklerin periyodik (devri) olduğunu görmüştür. Mendeleev, atom kütleleri sırasına göre kurduğu gruplarla, özellik bakımından benzeyen element yoksa, yerini boş bırakmıştır. Bunun sonucu olarak Mendeleevin periyodik cetveline bazı boşluklar meydana gelmiştir. Mendeleev, bu boşlukları açıklamasını bilmiş, o gün için bilinmeyen ve periyodik cetvelde 32 numaralı yeri olması gereken elementin özelliklerinin ne olacağını tahmin etmiştir. Ayrıca, Mendeleevin sisteminde boş kalan yerlerde bilinmeyen elementlerin bulunması gerektiği fikri yeni elementlerin keşfine yol açmıştır. Mendeleevi dahiyane görüşü ile, bu sistemin doğanın genel bir kanununa uyulduğunu sezmiş ve sistemini genelleştirmekten çekinmeyerek o gün için 63 element bilinmesine ve sisteminde pek çok boş yer kalmış olmasına rağmen, periyodik cetvelini geliştirmiştir. Periyodik cetvelin yapılmış olması elementleri inceleme kolaylığı sağladığı gibi bilinmeyen elementlerin özelliklerinden yola çıkarak keşfini sağlamıştır. Bu gün periyodik cetvelde elementler, atom kütlelerine göre değil, atom numaralarına göre dizilir. Böylece Mendeleevin sisteminin aksaklığı ortadan kalkar. Çünkü kimyasal özellikleri atom kütlelerinin periyodik bir fonksiyonu değil, artan atom numaralarının periyodik bir fonksiyonudur. Elementler artan atom numaralarına göre periyodik cetvelde dizildiğinde, elementlerin bazı özellikleri periyodik olarak tekrarlanır. Bunun nedeni, elementlerin elektron dizilişleriyle ilgilidir. Elementler, özellikleri birbirine benzeyen alt alta gelecek şekilde, artan atom numaralarına göre sıralandığında bir cetvel oluşturur. Oluşan bu cetvele periyodik cetvel denir. Periyodik cetvel elementlerin elektron dizilişine bağlı olarak dört bloktan (s, p, d, f) meydana gelir. Bloklardaki elementlerin değerlilik elektronları bulunduğu blokun adıyla aynı orbital dedir. Ör: Na------- 1s 2s 2p 3s :s blokundaP-------- 1s 2s 2p 3s 3p :p blokunda ORBİTAL:Bir atomun elektronlarının bulunma olasılığının yüksek olduğu uzay bölgesidir. Değerlik elektronları: Bir elementin en dış elektron kabuğunda bulunan elektronlara denir. Periyodik cetvelde yatay sütunlara periyot, düşey sütunlara grup denir.Periyodik cetvel 7 periyot ile 8A, 8B olmak üzere 16 gruptan (18 düşey sütundan) oluşur. Yeni sistemde gruplar A ve B diye ayrılmaz. Birden 16ya kadar sırayla 1,2,3.....16. grup diye adlandırılır. 1. periyotta 2 element bulunur. (H, Ne) 2. periyotta 8 element bulunur. (Li, Be, B, C, N, O, F, Ne) 3. periyotta 8 element bulunur. ( Na, Mg, Nı, Si, P, S, Cl, Ar) 4. periyotta 18 element bulunur. (K, Ca,..............................., Kr) 5. periyotta 18 element bulunur. (Rb, Sr, ............................., Ye) 6. periyotta 32 element bulunur. (Cr, Ba, ............................., Ra) Periyotta 32(yir4. ve 5. periyotlarda periyodun 10 element uzamasına d orbitalin dolması (d ) neden olur. 6. ve 7. periyotlarda ise sıranın 14 element uzamasına f orbitalinin dolması (f ) neden olur. F orbitallerine elektron dolan 14 elementten 6. sıradaki lantanitler (57-71 atom numara (1)) (noder toprak metalleri) ve 7. sıradaki aktinitler, (89-103) cetvelin daha fazla yana uzamamasından alt sırada f bloğuna alınmıştır. Periyodik cetvelin s bloğunda IA ve IIA, p bloğunda IIIA, IV A, VA, VIA, VIIA ve VIIIA grupları, d bloğunda ise IIIB, IVB, VB, VIB, VIIB, VIIIB, IB ve IIB grupları yer alır. Elementler artan atom numaralarına göre periyodik cetvele yerleştirildiğinde, cetvelin sol tarafından metallerin sağ tarafında ametallerin yer aldığı görülür.Her periyot bir alkali metal ile başlar bir soygaz ile biter. Gruplar ve özellikleri: A Grubu Elementleri: A grubu elementlerinin değerlik elektronları s ve p orbitallerinde bulunur. Elektron dizilişi, s orbitali ile sonuçlanan elementler s, p ile sonuçlananlar p, d ile sonuçlananlar d, f ile sonuçlananlar ise f bloğunda yer alır. Periyodik cetvelin IA grubunda (H, Li, Na, K, Rb, Cs, Fr) elementleri bulunur. Hidrojen IA grubunda bulunmakla beraber bir ametaldir. Hidrojen dışındaki bu grup ametallerinin hidrooksitleri kuvetli baz özelliği gösterdiğinden, IA grubu elementler bazik anlamına gelen alkali metaller adıyla anılır. Alkali metaller, en dış orbitalleri olan küresel s değerlik orbitallerinde bir değerlik elektronu taşır. Bu elementlerin elektron dizilişlerinin benzerliği bir çok özelliklerinde benzerliğe yol açar IA grubu elementleri dış orbitallerdeki bir tek değerlik elektronu kolaylıkla vererek +1 yüklü iyon haline geçer. Metalik parlaklık gösterir, bıçakla kesilebilecek kadar yumuşaktırlar. Elektrik ve ısıyı iletir.(Bu yazıdaki bilgiler ataçelik.com tarafından sağlanmaktadır.) Periyodik cetvelin IIA grubunda (Be, Mg, Ca, Sr, Ba, Ra) elementleri bulunur. Bunlar toprak alkali metaller olarak anılır. Bu grup elementleri atomların s değerlik orbitalinde 2 elektron bulunur. Bu elektronlar, IA grubu elementlerinin tek elektronu kadar olmasa da yine kolaylıkla ortamdan kopar. Bu nedenle IIA grubu elementleri +2 değerlikli iyon halinde bileşik oluşturur. Bu grupta yer alan elementler IA grubu elementlerinden daha az aktif, daha yoğun ve daha serttir. Periyodik cetvelin IIA grubunda hepsi ametal olan flüor (f), klor(Cl), brom (Br), iyot (ı) ve astaton (At) elementleri bulunur. Bunlara tuz üreten anlamına gelen halojen adı verilir. Oda sıcaklığında F ve Cl gaz, Br sıvı, I ise katı halde bulunur. Halojen atomlarının s ve p değerlik orbitallerinde yedi tane değerlik elektronu vardır. Halojenler kararlı hale gelmek için genellikle dışarıdan bir elektron alarak -1 değerlikli iyonlar halinde bileşik oluşturur. Bu halojenler bir kısım bileşiklerinde +1, +3, +4, +5, +6, +7 değerlikli olabilir. Halojenler oldukça aktiftir. B Grubu elementleri : Değerlik elemanları son olarak d orbitalinin doldurduğu elementlerin yer aldığı gruplardır. III B ile başlayıp II B ile sonlanan gruplarda yer alan elementlere geçiş elementleri ya da geçiş metalleri denir. Geçiş elementleri kimyasal tepkimelerinde d orbitalinden önce s orbitalinden elektron verir. Bu elementler genellikle birleşiklerinde çok farklı değerlikli iyon halinde bulunur. B grubu elementlerinin tamamı metaldir, 30 elementtir. Elektron dizilişleri f orbitali ile sonlanan elementlere iç geçiş elementleri denir. Bu elementler periyodik cetvelin altında f bloğunda bulunur. Hepsi metaldir. Lantanitlerde Pm elementi dışındakiler radyoaktif değildir. Aktiniflerin ise tamamı radyoaktiftir. Grupların incelenmesinde dikkat çekici yön, aynı grupta yer alan elementlerin son orbital türü ile bu orbitallerde yer alan elektron sayısındaki aynılıktır. Bu aynılık, aynı grupta yer alan elementlerin kimyasal özelliklerinin benzerliğine neden olur. VIII A veya 0 (sıfır) grubu elementleri ( He, Ne, Ar, Xe, Rn ) soy gazlar olarak bilinir. Değerlik elektronları değerlik orbitallerini tamamen doldurmuştur. Çok zor şartlarda çok az bileşik yaparlar. Bu nedenle bileşik yapamaz olarak bilinirler. Doğada tek atomlu olarak bulunurlar, renksizdirler. Periyodik özellikler : Periyodik cetvelde elementlerin atom numaralarına bağlı olarak yerleri değiştikçe atom çapları ve elektron dizilişleri farklılık gösterir. Bu durum elementlerin özelliklerinde de periyodik değişmelere neden olur. Özelliklerdeki değişmeler periyot ve gruplara göre şöyle özetlenebilir; A) Periyotlarda soldan sağa gidildikçe; 1- Atom numarası büyür, değerlik elektron sayısı büyür 2- Atom kütlesi büyür 3- Atom çapı küçülür 4-Orbital sayısı değişmez 5- İyonlaşma enerjisi artar ( Bu artışta küresel simetrik durumlar istisna oluşturur ) 6- Elektron ilgisi ve elektronegatiflik artar 7- Metalik özellikler ( elektrik, ısı iletkenliği vb. ) azalır, amettallik özellikler artar. 8- Metallerin erime-kaynama noktaları yükselir, sertlikleri artar hidroksitlerinin bazlık kuvveti azalır. Amettallerin erime ve kaynama noktaları düşer, asitlerinin asitlik güçleri artar. 9- Metallerin kimyasal tepkime ilgileri (aktiflikleri) azalırken, ametallerin kimyasal tepkime ilgileri artar. İyonlaşma enerjisi :
|
Copyright 2000 ©, Ataçelik Dökümhanesi. Design by A.O.K